Tembaga (II) Ammonium Behidrat dan Tembaa (II) Tetraamin Sulfat
Behidrat
I.
Tujuan
Mempelajari
pembuatan Tembaga (II) Ammonium Behidrat
dan Tembaa (II) Tetraamin Sulfat Behidrat.
II.
Dasar Teori
Tembaga (Cu) merupakan
salah satu unsur logam yang paling ringan dan paling aktif. Cu+
mengalami disproporsionasi secara spontan pada keadaan standar (baku). Hal ini
bukan berarti senyawa larutan Cu(I) tidak mungkin terbentuk. Untuk menilai pada
keadaan bagaimana Cu(I) dan Cu(II) terbentuk, yaitu membuat (Cu+)
cukup banyak pada larutan air, Cu2+ akan berada pada jumlah banyak
(sebab konsentrasinya harus sekitar dua juta dikalikan pangkat dua dari Cu+).
Disproporsionasi ini akan menjadi sempurna. Dilain pihak jika Cu+
dijaga sangat rendag (seperti pada zat yang sedikit larut atau ion kompleks
mantap). Cu2+ sangat kecil
dan tembaga(I) menjadi mantap. (Petrucci, 1987 : 350)
Tembaga (Cu) adalah
logam merah muda yang lunak, dapat ditempa dan liat. Tembaga melebur pada 1038o
C. Karena potensial elektroda standar positifnya (+0,34 V untuk pasangan Cu/ Cu2+),
tembaga tidak larut dalam asam klorida dan asam sulfat encer, meskipun dengan
adanya oksigen ia dapat larut sedikit. Asam Nitrat yang sedang pekatnya (8M)
dengan mudah melarutkan tembaga. (Svehla, 1990 : 229)
Tembaga membentuk
senyawa dengan tingkat oksidasi +1 dan +2, namun hanya tembaga (II) yang stabil
dan mendominasi dalam larutannya. Dalam air, hamper semua garam tembaga (II)
berwarna biru oleh karena warna ion kompleks koordinasi enam [Cu(H2O)6]2+.
Reaksi ion Cu2+ dengan OH- pada berbagai konsentrasi
bergantung pada modelnya. Penambahan ion hidroksida ke dalam larutan tembaga
(II) sulfat (0,1 – 0,5 M) secara bertetes dengan kecepatan ~ 1 Ml/menit
menyebabkan terjadinya endapan gelatin biru muda dari garam tembaga (II)
hidroksida, bukan endapan Cu(OH)2. (Sugiarto, 2003 : 569)
Senyawa tembaga bersifat
diamagnetic. Tembaga sulit teroksidasi superficial dalam udara kadang
menghasilkan lapisan warna hijau hidroksida karbonat dan hidrokso sulfat dan SO2,
di atmosfer tembaga mudah larut dalam asam nitrat dan asam sulfat dengan adanya
oksigen. Kestabilan relative kepro kopro diartikan denan potensial Cu* = 0,52V
dan Cu+ = 0,153V. Kestabilan relative tergantung pada sulfat anion
dan ligan yang cukup beragam dengan pelarut/sifat fisik atom tetangganya dalam
Kristal. Pelarutan tembaga hidroksida karbonat dan sebagainya dalam asam yang
dihasilkan aquo hijau keboruan yang ditulis [Cu(H2O)6]2+.
Diantara berbaai Kristal hidratnya adalah sulfat biru CuSO4.5H2O
yang paling lazim. CuSO4.5H2O dapat dihidrasi menjadi zat
anhidrat yang berwarna putih. Penambahan ligan menyebabkan kompleks dengan
pertukaran molekul air secara berurutan. (Syukri, 1999 : 321)
III.
Alat dan Bahan
·
Alat
a)
Gelas piala 250 ml
b)
Gelas ukur
c)
Corong
d)
Corong buncher
e)
Batang pengaduk
f)
Kaca arloji
·
Bahan
a)
CuSO4.5H20
b)
NH4OH 15N
c)
Eter
d)
(NH4)2SO4
e)
Alkohol 95%
f)
Aquadest
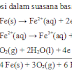




No comments:
Post a Comment