PEMBUATAN GARAM MOHR
I.
Tujuan
- Membuat garam mohr atau besi (II) ammonium sulfat (NH4)2Fe(SO4)2.6H2O
- Menentukan banyaknya air kristal dalam garam mohr hasil prcobaan
II.
Dasar Teori
Ada dua bijih besi yang terpenting yaitu : hematit (Fe2O3)
dan magnetit (Fe3O4). Dan garam besi (II) yang terpenting
adalah garam besi (II) sulfat yang dibuat dari pelarutan besi atau besi (II)
sulfida dengan asam sulfat encer, setelah itu larutan disaring, lalu diuapkan
ldan mengkristal menjadi FeSO4.7H2O yang berwarna hijau.
Dalam skala besar garam ini dibuat dengan cara mengoksidasi perlahan-lahan FeS
oleh udara yang mengandung air.
Garam-garam
besi (II) atau fero diturunkan dari besi (II) oksida, FeO dalam larutan.
Garam-garam ini mengandung kation Fe2+ dan berwarna sedikit hijau.
Ion besi (II) dapat mudah dioksidasi menjadi besi (III), maka merupakan zat
pereduksi yang kuat. Semakin kurang asam larutan itu, semakin nyatalah efeknya
dalam suasana netral atau basa bahkan oksigen dari atmosfer akan mengoksidasi
ion besi (II). Maka larutan besi (II) harus sedikit asam bila ingin disimpan
untuk waktu yang agak lama.
Garam
besi (II) sulfat dapat bergabung dengan garam-garam sulfat dari garam alkali,
membentuk suatu garam rangkap dengan rumus umum yang dapat digambarkan sebagai
M2Fe(SO4)6H2O, dimana M merupakan simbol dari
logam-logam, seperti K, Rb, Cs dan NH4. Rumus ini merupakan gabungan
dua garam dengan anion yang sama atau identik yaitu M2SO4FeSO4.6H2O.
Untuk
garam rangkap dengan M adalah NH4, yang dibuat dengan jumlah mol
besi (II) sulfat dan ammonium sulfat sama, maka hasil ini dikenal dengan garam
mohr. Garam mohr dibuat dengan mencampurkan kedua garam sulfat dari besi (II)
dan ammonium, dimana masing-masing garam dilarutkan sampai jenuh dan pada besi
(II) ditambahkan sedikit asam. Pada saat pendinginan hasil campuran pada kedua
garam di atas akan diperoleh kristal yang berwarna hijau kebiru-biruan dengan
bentuk monoklin. Garam mohr tidak lain adalah garam rangkap besi (II)ammonium
sulfat dengan rumus molekul (NH4)2FeSO46H2O
atau (NH4)2(SO4)26H2O.
Garam
mohr, besi ammonium sulfat, merupakan garam rangkap dari besi sulfat dan
ammonium sulfat dengan rumus molekul [NH4]2[Fe][SO4]2.6H2O.
garam mohr lebih disukai dari pada besi (II) sulfat untuk proses titrasi karena
garam mohr tidak mudah terpengaruh oleh oksigen bebas di udara/ tidak mudah
teroksidasi oleh udara bebas dibandingkan besi (II).
Kristal
adalah suatu padatan yang atom, molekul, atau ion penyusunnya terkemas secara
teratur dan polanya berulang melebar secara tiga dimensi. Secara umum, zat cair
meembentuk kristal ketika mengalami proses pemadatan. Pada kondisi ideal,
hasilnya bisa berupa kristal tunggal, yang semua atom-atom dalam padatannya
“terpasang” pada kisi atau struktur kristal yang sama, tetapi secara umum
kebanyakan kristal terbentuk secara simultan sehingga menghasilkan padatan
polikristalin. Struktur kristal mana yang akan terbentuk dari suatu cairan
tergantung pada kimia cairannya sendiri, kondisi ketika terjadi pemadatan, dan
tekanan ambien.proses terbentuknya struktur kristalin dikenal sebagai
kristalisasi.
III.
Alat dan Bahan
Ø Alat
·
Gelas piala
·
Gelas ukur
·
Neraca
Ø Bahan
·
Serbuk besi
atau paku
·
Asam Sulfat
10%
·
Ammonia
pekat
IV.
Cara Kerja
Larutan A
Larutan A dan B
V.
Hasil
Pengamatan
Larutan
A
No
|
Perlakuan
|
Hasil Pengamatan
|
1
|
Dilarutkan 3,5 gr besi dalam 100 ml asam sulfat 10 %,
dipanaskan
|
Besi larut.
Larutan berwarna hijau
|
2
|
Disaring ketika
larutan masih panas
|
Larutan berwarna
hijau
|
3
|
Ditambahkan asam sulfat pada filtrat
|
Larutan berwarna hijau
|
Larutan B
No
|
Perlakuan
|
Hasil Pengamatan
|
1
|
Dinetralkan 50 ml asam sulfat 10 % dengan amoniak.
Diuapkan larutan
|
Larutan bening (sampai pH=7)
|
Larutan A dan B
No
|
Perlakuan
|
Hasil Pengamatan
|
1
|
Dicampurkan larutan A dan B ketika masih panas
|
Terbentuk kristal berwarna hijau dengan endapan putih.
|
2
|
Dipisahkan larutan
dengan endapan yang terbentuk dengan kertas saring
|
Terbentuk kristal-kristal
garam.
|
3
|
Ditimbang kristal yang diperoleh
|
9,05 gram
|
Berat garam mohr yang
didapat dari percobaan sebesar = 9,05 gram.
VI. Reaksi
dan Perhitungan
Reaksi
a)
Fe + H2SO4 → FeSO4
+ H2O
b) 2NH3 + H2SO4
→ (NH4)2SO4
c) FeSO4 + (NH4)2SO4
+ 6H2O → (NH4)2Fe(SO4)2.6H2O
P Perhitungan
·
Massa kertas
saring (b) = 1,55 gram
·
Massa hasil
penyaringan/kertas saring+kristal (a) =
10,6 gram
·
Massa garam
Mohr =
a-b
= 10,6 – 1,55 = 9,05 gram
·
Massa besi
(Fe) =
3,5 gram
·
BM besi (Fe) =
55,85 gram/mol
·
BM garam
Mohr =
392 gram/mol
·
mol Fe = mol
garam Mohr =
massa Fe / BM Fe
= 3,5 / 55,85 = 0,063 mol
·
Massa garam
Mohr (teori)
=
mol garam Mohr x BM garam Mohr = 0,063x392 = 24,096 gram
·
Kemurnian kristal
=
(m garam mohr teori - m garam mohr perc. / m garam mohr teori )x 100%
= (24,096 - 9,05 / 24,096) x 100%
= 62,44 gram
VII. Pembahasan
Praktikum kali ini bertujuan untuk membuat garam mohr
atau besi (II) ammonium sulfat serta menentukan banyaknya air kristal didalam
percobaan yang dilakukan. Percobaan pembuatan garam mohr diawali dengan membuat larutan A. Pada
percobaan ini Larutan A dibuat dengan melarutkan serbuk besi 3,5 gram dalam 100
ml H2SO4 10 %. Serbuk besi melarut sedikit demi sedikit hingga
warna pada serbuk besi menjadi abu-abu. Digunakannya asam sulfat dalam
melarutkan serbuk besi karena asam sulfat merupakan pelarut yang mengandung
proton yang dapat diionkan dan berupa asam kuat atau lemah. Larutan
tersebut dipanaskan sampai semua besi larut. Tujuan dilakukannya pemanasan adalah
sebagai katalis yaitu untuk mempercepat terjadinya reaksi sehingga hampir semua
besi larut. Pemanasan dilakukan secara perlahan dengan api sedang agar tidak
terjadi oksidasi pada besi (Fe) serta dapat menghilangkan gas H2 dan
mempercepat pembentukan ion Fe2+ yang ditandai dengan terbentuknya larutan
berwarna kehijauan.
Kemudian larutan tersebut disaring dalam keadaan panas
dengan mengunakan kertas saring. Adapun tujuan dari penyaringan adalah untuk
memisahkan larutan dari filtratnya, dan penyaringan dalam keadaan panas berfungsi
untuk menghindari terbentuknya kistal pada suhu yang rendah. Kemudian ditambahkan
5 tetes H2SO4 ke dalam filtrat tersebut sampai terbentuk
kristal di permukaan larutan. Penambahan 5 tetes H2SO4 tersebut
bertujuan untuk mengoksidasi logam Fe menjadi ion logam Fe2+. Larutan
ini terus diuapkan dengan tujuan untuk mengurangi molekul air yang ada pada
larutan. Percobaan ini manghasilkan garam besi (II) sulfat yang merupakan garam
besi (II) yang terpenting. Dalam larutan, garam-garam ini mengandung kation Fe2+
sehingga berwarna hijau.
Setelah didaptkan hasil garam besi (II) sulfat,
percobaan dilanjutkan dengan membuat Larutan B. Pembuatan larutan B diawali
dengan menetralkan 100 ml H2SO4 10% dengan amoniak (NH3),
sehingga dihasilkan larutan (NH4)2SO4 dengan
pH=7 (netral). Kemudian larutan ini diuapkan sampai jenuh (volume menjadi
setengahnya) dengan tujuan untuk menguapkan NH3.
VIII. Kesimpulan
· Campuran
besi (II) sulfat dengan larutan amonium sulfat menghasilkan garam, yang disebut
dengan garam mohr.
·
Garam Mohr
yang didapat sebesar 9,05 gram dengan tingkat kemurniannya adalah sebesar 62,44 gram.
IX. Daftar
Pustaka
Chalid, Sri Yadial. 2011. Penuntun
Praktikum Kimia Anorganik. Jakarta : UIN Syarif Hidayatullah.
Cotton and Wikinson. 1989. Kimia Anorganik Dasar. Jakarta : UI-
Press.
Svehla, G. 1990. Vogel: Buku Teks
Analisis Anorganik Kualitatif Makro dan Semimikro Bagian I. Jakarta : PT Kalman Media Pustaka.
X. Lampiran
1. Apa tujuan penambahan asam
sulfat pada filtrat ?
Penambahan tersebut bertujuan
untuk membuat larutan sedikit asam karena larutan tersebut bersifat basa dan
kation Fe+ sangat mudah teroksidasi diudara bebes menjadi Fe3+,
oksidasi ini dapat menyebabkan pembuatan garam Mohr menjadi terhambat.
2. Apa fungsi dari garam Mohr
?
a) Untuk membuat larutan baku Fe2+ bagi analisis volumetri.
b) Untuk meramalkan urutan daya mengoksidasi oksidator K2Cr2O7,
KMnO4 dan KBrO3 (dengan konsentrasi yang sama ~0,1 N) terhadap ion Fe2+.
c) Sebagai zat pengkalibrasi dalam pengukuran magnetik.
3. Tulis semua reaksi yang
terdapat pada percobaan ini !
a)
Fe + H2SO4 → FeSO4 + H2O
b)
2NH3 + H2SO4 → (NH4)2SO4
c)
FeSO4 + (NH4)2SO4 + 6H2O
→ (NH4)2Fe(SO4)2.6H2O



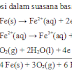




No comments:
Post a Comment