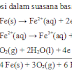SIFAT KIMIA SENYAWA KLOR
I. Tujuan
- Mengetahui kelarutan dan stabilitas garam klorida
- Mempelajari pembentukan senyawa kompleks logam transisi dengan ion klorida
Unsur-unsur halogen dapat diidentifikasikan melalui warna dan sifatnya. Misalnya Cl: berupa gas kuning kehijauan pada suhu kamar, non polar, kelarutan dalam air kecil dan larut dalam pelarut non polar.
Semua halogen dapat mengoksidasi air menjadi gas O2 dan bukan merupakan oksidator kuat. Larutan halogen tidak stabil karena cenderung mengalami auto-oksidasi atau auto-reduksi, proses ini disebut dengan disporposionasi:
2Cl2 (aq) + 2H2O ----> HClO (aq)
+2HCl(aq)
Pada reaksi tersebut Cl2 mengalami reaksi reduksi dan reaksi oksidasi. Pemutih klorin (bleaching agent) mengandung larutan hipoklorit (NaOCl). Ion ClO merupakan suatu oksidator daya oksidasinya sama dengan klorin namun ion ClO- adalah basa yang cukup kuat.
Klor digunakan secara luas dalam pembuatan banyak produk sehari-hari. Klor digunakan untuk menghasilkan air minum yang aman hampir diseluruh dunia. Bahkan, kemasan air terkecil pun sudah terklorinisasi.
Klor juga digunakan secara besar-besaran pada proses pembuatan kertas. zat perwarna, tekstil, produk olahan minyak bumi, obat-obatan, antiseptik, insektisida, makanan, pelarut, cat, plastik dan banyak produk lainnya.
Ion Klorida membentuk endapan dengan ion-ion Ag+, Pb+, Hg+ berperan sebagai ligan dalam pembentukan kompleks yang diamati melalui perubahan warna dan melarutnya endapan atau padatan.
Kebanyakan klor diproduksi untuk digunakan dalam pembuatan senyawa klorin untuk sanitasi, pemutihan kertas, disinfektan, dan proses tekstil. Lebih jauh lagi, klor digunakan untuk pembuatan klorat, kloroform, karbon tetraklorida, dan ekstraksi brom.
Pemutih Klorin (bleching agent) mengandung larutan hipoklorit (NaOCl), Ion ClO merupakan suatu oksidator, daya oksidasinya sama dengan klorin namun ion ClO- berbeda dengan Cl-sebab asam hipoklorit, HClO adalah asam emah dan ion ClO- adalah basa yang cukup kuat, sedangkan Cl- mempunyai sifat netral dan merupaka basa konjugat dari HCl kuat. Ion Klorida membentuk endapan dengan ionion Ag+, Pb+, dan Hg+, berperan sebagai ligan dalam pembentukan kompleks yang diamati melalui perubahan warna dan melarutnya endapan atau padatan
III. Alat dan Bahan
Alat
- Pipet tetes
- Rak tabung reaksi
- Gelas ukur
- Tabung reaksi
- NaCl 0,1 M
- AgNO3 0,1 M
- NH3 6 M
- CuSO4 0,1 M
- Lakmus meran dan biru
- NaOCl 5%
- NaOH 6 M
- KI 0,1 M
- KBr 0,1 M
- n-heksana atau petroleum eter
- HCl pekat
1. Ion Klorida Cl-
a. Kelarutan dan kestabilan gran klorida
- Dimasukkan 1 ml NaCl + 1 ml AgNO3 kedalam tabung
- Diaduk larutan hingga merata dan ditambahkan sejumlah volume yang
- Diaduk campuran agar endapan yang terbentuk larut
- Ditambahkan HNO3 6 M sedikit berlebih dan diaduk
b. Kompleks logam transisi dengan ion Cl-
- 2 ml CuSO4 0,1 M + 2 ml HCl pekat dimasukkan kedalam tabung reaksi
- Diencerkan campuran dengan 5 ml aquadest. diamati yang terjai
- Ditambahkan 3 ml HCl pekat kedalam AgNO3 0,1 M
- Diaduk beberapa menit agar endapan kembali
- Dimasukkan 1 ml NaCl + 1 ml AgNO3 kedalam tabung reaksi
- Diencerkan campuran dengan 5 ml aquadest. Diamati yang terjadi
a. Reaksi Lakmus
- Diteteskan larutan NaOCl 5 % pada kertas lakmus merah dan biru
- Diamati perubahan warna yang terjadi
- 1 ml AgNO3 0,1 M + 3 ml NaOCl
- Diamati endapan yang terbentuk
- Ditambahkan HNO3 6 M
- Dibandingkan dengan campuran NaOH 6 M dengan AgNO3
- Diamati perubahan yang terjadi
- 2 ml KI 0,1 M dan 1 ml n-heksana (dikerjakan diruang asam)
- Dimasukkan kedalam tabung reaksi
- Ditambahkan beberapa tetes larutan NaOCl 5% sambil diaduk
- Dicatat perubahan warna yang terjadi pada lapisan heksana
- Dihindari kelebihan NaOCl karena dapat menghilangkan warna I2 yang terbentuk dan produk awal akan teroksidasi menjadi OCl- terhadap larutan KI, KBr serta larutan yang telah diasamkan
V. Hasil Pengamatan
1. Ion
klor (Cl-)
a. Kelarutan
dan stabilitas garam klorida
(i) NaCl + AgNO3 → endapan putih
(ii) (i) + NH3 → endapan putih
(iii)
(ii) + HNO3 → endapan putih +
panas + gas
b. Kompleks
logam transisi dengan ion Cl-
(i) CuSO4 + HCl → biru kehijauan
(ii) (i) + H2O → biru
(iii)
AgNO3 + HCl → endapan putih
(iv) (iii) + H2O → endapan putih
2. Ion
Hipoklorit (ClO-)
a. Lakmus
(i) NaClO + lakmus merah → biru
(ii) NaClO + lakmus biru → merah
b. Reaksi
dengan AgNO3
(i) NaOCl + AgNO3 → endapan putih
(ii) (i) + HNO3 → endapan putih
(iii) NaOH + AgNO3 → endapan abu
kehitaman
(iv) (iii) + HNO3 → kenaikan suhu
c. Daya
Oksidasi ion ClO-
(i) KI + C6H12 + NaClO
→ terbentuk dua lapisan yaitu pink dan kuning
(ii) KBr + C6H12 + NaClO
→ bening, terbentuk dua lapisan yaitu bagian atas berminyak dan bagian bawah
tidak
(iii) (i) + HCl → terbentuk dua lapisan yaitu
orange dan ungu
(iv) (ii) + HCl → terbentuk dua lapisan yaitu
bagian atas berminyak dan bagian bawah tidak
VI. Pembahasan
Pada percobaan kali ini akan dibahas mengenai sifat kimia
senyawa klor. senyawa klor yang duijikan
untuk mengetahui kelarutan dan stabilitas garam klorida serta senyawa kompleks
logam transisi dengan ion klorida. Percobaan yang pertama yaitu mencampurkan 1
ml NaCl 0,1 M dan 1 ml AgNO3 0,1 M, reaksi tersebut menghasilkan
endapan putih. Endapan tersebut berasal dari AgCl yang terbentuk melalui
penambahan AgNO3 kedalam NaCl. Persamaan reaksinya adalah:
AgNO3(aq) +
NaCl(aq) → AgCl(s) + NaNO3(aq)
Endapan yang terbentuk
pada perak klorida dikarenakan hasil kali kepekatan ion-ion yang ada dalam
larutan lebih besar daripada hasil kali kelarutannya.kesetimbangan antara
endapan AgCl dan larutan jenuhnya dinyatakan dengan persamaan reaksi berikut:
AgCl(s) ↔ Ag+ + Cl-
Dalam reaksi tersebut
perak klorida terbentuk solid, sehingga mempengaruhi endapan. Selanjutnya hasil
campuran larutan tersebut ditambahkan NH3 6M sebanyak 1 ml. Penambahan
amonia tidak mengubah apa pun. Endapan putih masih terbentuk. Seharusnya endapan
tersebut larut. Karena penambahan amonia menyebabkan terbentuknya ion kompleks
diaminaargentat.
AgCl +
2NH3 → [ Ag(NH3)2 ]+
+ Cl-
Dimana, [
Ag(NH3)2 ]+ merupakan filtrat dari
penambahan larutan amonia (NH3) ke dalam endapan dari AgCl. Apabila
filtrat tersebut diasamkan dengan asam nitrat (HNO3), maka
kesetimbangan pada reaksi penambahan larutan amonia akan kembali lagi.
Selanjutnya adalah
mereaksikan antara tembaga(II)sulfat dengan asam klorida. Sebelum direaksikan
warna larutan tembaga(II)sulfat adalah biru. Setelah ditambahkan asam klorida warna
larutan menjadi biru kehijauan. Perubahan warna ini disebabkan karena di dalam
larutan tembaga(II)sulfat mengandung ion heksaaquotembaga(II), setelah
penambahan asam klorida, enam molekul air digantikan oleh empat ion
klorida. Sehingga terbentuk ion kompleks Cu dengan klorida [CuCl4]2- yang
memberikan pewarnaan biru kehijauan pada larutan. Reaksi yang terjadi
berlangsung reversibel. Karena reaksi yang terjadi merupakan reaksi dua arah
menyebabkan jika ke dalam larutan ini ditambahkan aquades warna larutan kembali
menjadi warna biru.
Berikutnya adalah
menguji pengaruh NaOCl bila diteteskan ke kertas lakmus merah maupun biru. Melalui
hasil percobaan bahwa saat kertas lakmus biru dicelupkan ke dalam larutan
natrium hipoklorit terjadi perubahan warna kertas lakmus menjadi berwarna
merah, begitu pula saat kertas lakmus merah dicelupkan ke dalam larutan natrium
hipoklorit terjadi perubahan warna menjadi warna biru. Hal ini menunjukkan
bahwa natrium hipoklorit bersifat amfoter, memiliki sifat asam dan juga
memiliki sifat sebagai basa.
Percobaan selanjutnya
yaitu mereaksikan perak nitrat dengan natrium hipoklorit. Reaksi antara natrium
hipoklorit dengan perak nitrat menghasilkan endapan putih perak klorida. Setelah
dilakukan penambahan asam nitrat, tidak terjadi perubahan (masih terbentuk
endapan putih). Sementara untuk reaksi antara perak nitrat dengan natrium
hidroksida menghasilkan endapan berwarna abu-abu kehitaman dari perak oksida.
AgNO3 +
NaOH → AgOH↓ + NaNO3 + H2O
Endapan
abu-abu kehitaman ini tidak larut saat ke dalam larutan ditambahkan asam nitrat,
tetapi terjadi kenaikan suhu yang ditandai dengan tabung reaksi yang panas bila
dipegang.
Percobaan yang
terakhir yaitu mengenai daya oksidasi dari ion ClO-. Pertama
praktikan mereaksikan antara larutan kalium iodida dengan larutan heksana,
menghasilkan larutan yang heterogen dimana terdapat cincin berwarna pink pada
bagian atas larutan. Setelah ditambahkan dengan natrium hipoklorit larutan
berubah warna menjadi warna kuning dengan tetap terbentuk dua layer pada tabung
reaksi, yaitu pada bagian atas berwarna pink dan bagian bawah berwarna kuning. Kemudian
setelah ditambahkan asam klorida warna larutannya berubah menjadi warna orange
dan ungu.
Berikutnya adalah
mereaksiakan larutan kalium bromida dengan heksana serta natrium hipoklorit. Hasil
dari reaksi tersebut terbentuk larutan yang heterogen, yang ditandai dengan
terbentuknya dua lapisan. Lapisan atas berupa minyak dan lapisan yang bawah
bening. Hal ini dapat terjadi mungkin karena perbedaan kepolaran serta massa
jenis sehingga mempengaruhi hasil larutan. Kemudian setelah penambahan asam
klorida, larutan tersebut tidak mengalami perubahan.
VII.
Kesimpulan
1. Senyawa klor dapat membentuk kompleks dengan logam
transisi
2. Ion klorida dapat mengalami reduksi maupun oksidasi
VIII. Daftar
Pustaka
Chang, Raymond.
2003. Kimia Dasar Konsep-Konsep Inti.
Edisi ketiga. Jilid 1. Jakarta: Erlangga
Vogel. 1985. Analisis
Anorganik Kualitatif Makro dan Semimikro. Jilid 1. Jakarta: Kalman Media Pusaka
Vogel. 1985. Analisis
Anorganik Kualitatif Makro dan Semimikro .Jilid 2. Jakarta: Kalman Media Pusaka
Yadial C,
Sri. 2011. Penuntun Praktikum Kimia Anorganik. Jakarta: UIN
Syarif Hidayatullah
IX. Lampiran
Pertanyaan:
1.
Tuliskan contoh-contoh senyawa klor dengan bilangan
oksidasi Cl (-1, 0, +1, +3, +4, +5, +7) dan sebutkan kegunaannya kalau ada?
Biloks
|
Senyawa
klor
|
Kegunaan
|
-1
|
NaCl
|
sebagai
bahan pengamat dan bahan campuran
|
untuk
membuat es krim
|
||
0
|
Cl2
|
sebagai senjata perang pada perang dunia II
|
+1
|
NaOCl
|
sebagai
pemutih pakaian
|
+3
|
NaClO2
|
sebagai pemutih dlam industri tekstil dan kertas
|
digunakan
pada pengolahan air sebagai desinfektan
|
||
terdapat pada obat kumur dan pasta gigi
|
||
+4
|
NaClO3
|
sebagai
herbisida
|
+5
|
NH4ClO4
|
sebagai
campuran bahan bakar roket
|
+7
|
HClO4
|
Sebagai
bahan desinfektan
|
2.
Bagaimana
cara membuat larutan pemutih NaClO secara komersial. Tuliskan reaksinya !
Larutan
pemutih dapat dibuat dengan mereaksikan NaOH dengan gas klor (Cl2),
gas klor dilewatkan ke dalam larutan dingin NaOH encer pada suhu < 40º C, jika suhu > dari 40 oC
maka akan membentuk natrium klorat (NaClO3)
2NaOH + Cl2 → NaCl + NaOCl + H2O
3.
Bagaimana cara zat pemutih dapat membuat pakaian
kelihatan lebih putih?
Zat pemutih
bekerja dengan dua cara, yaitu :
a. Mengubah
molekul menjadi zat yang tidak mengandung kromofor atau masih mengandung
kromofor yang tidak menyerap cahaya visible dengan cara memutuskan ikatan kimia
kromofor oleh pemutih yang bersifat oksidator.
b. Mengubah
ikatan rangkap pada kromofor menjadi ikatan tunggal oleh pemutih yang bersifat
rediktor. Pemutusan ikatan rangkap ini dapat mengurangi kemampuan kromofor
menyerap sinar visible.
Berikut adalah gambar hasil percobaan:
Berikut adalah gambar hasil percobaan:
keterangan gambar dari kiri ke kanan, yaitu kelarutan dan kestabilan garam klorida (NaCl+AgNO3+HNO3), NaCl+AgNO3 +aquadest, HCl+AgNO3 , NaOH+AgNO3 , KI+n-heksana+NaOCl .